
磕碰酿成的外伤、手术留住的伤口、跟着年齿增长带来的肌肉退化,这类常见的组织毁伤是生存中不行幸免的一部分,毁伤拔擢和组织再生的快慢平直影响着东谈主体的身体现象和健康。炎症响应付组织毁伤后的拔擢至关纰谬,一些临床接头标明,术后过早使用抗炎药可能会导致伤口愈合不良。因此chatgpt 文爱,深刻接头早期炎症是如何运转后期组织重建,其纰谬性显而易见。
良渚执行室/浙江大学医学院王迪教讲课题组发现,当东谈主体组织受到毁伤,会激活巨噬细胞干涉一种“超活化”现象,在细胞膜上形成GSDMD卵白孔洞手脚通谈开释特定脂质分子来促进组织毁伤拔擢。近日,团队在《当然》杂志发表该接头效果,论文题为Gasdermin D-mediated metabolic crosstalk promotes tissue repair。
“超活化”带来的可能性
巨噬细胞是一种遍布东谈主体,参与炎症响应的关节免疫细胞。GSDMD手脚巨噬细胞上介导炎症响应的关节因子,在抗争病原体入侵和炎症性疾病中阐述重邀功能。以往的接头觉得,机体遭受危急时会促使GSDMD活化,在细胞膜上打孔形成孔谈并激发细胞焦一火。
干系词,课题组在执行中发现,在组织毁伤拔擢经过中,巨噬细胞上形成的孔谈并不都会导致细胞牺牲。此时的巨噬细胞仍然保留特定功能并处于一种“超活化”现象。
那么“超活化”现象的巨噬细胞是如何影响组织毁伤拔擢的呢?
课题组揣度,这种巨噬细胞是否判辨过GSDMD孔谈主动分泌生物活性代谢物等效应因子,来影响阁下细胞或参与塑造其所处的组织微环境呢?
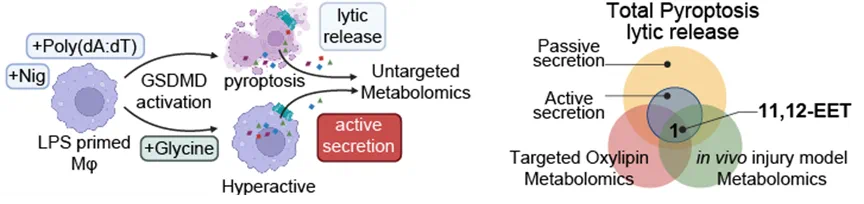
沿着这条踪影,课题组惊羡地发现,巨噬细胞在开释炎症因子的同期,确乎也通过GSDMD分泌一些特异性的代谢物。
 chatgpt 文爱
chatgpt 文爱
“超活化”现象的巨噬细胞可影响组织毁伤拔擢
通过对体外“超活化”巨噬细胞上清液和体内肌肉间质液进行代谢组学分析,多种筛选计策的边界都指向了归并种脂质代谢物——11,12-EET,它在GSDMD激活后主动开释到毁伤组织的微环境中。
神奇的“拔擢剂”
组织拔擢离不开干细胞的增殖和分化智商。这照旧过中,干细胞并非“鳏寡孤惸”,它需要周围其他细胞的协助支援。如若把干细胞比作一颗充满无穷但愿的种子,它的萌芽和成长离不开泥土赐与营养。在这里,干细胞需要的“泥土”等于它所处的毁伤微环境。
巨噬细胞手脚这个微环境中的纰谬一员,通过分泌促/抗炎介质、滋长因子和其他生物活性分子阐述一系列复杂作用,但巨噬细胞与其他细胞类型之间的代谢通信,以及这些胞间通信如何共同协作促进组织拔擢的探索较少。
巨乳露出因此,团队从“关节点”11,12-EET出手,收受双管皆下的接头计策,一方面通过外源性平直补充11,12-EET,另一方面通过在小鼠巨噬细胞中敲除其水解酶,从而在内源层面擢升11,12-EET的含量。这两种计策的论断都有劲地解释,11,12-EET在促进肌肉干细胞激活和增殖中阐述着积极的作用。
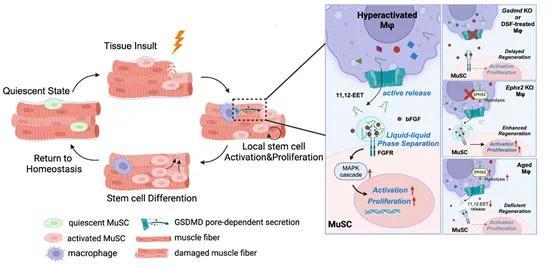
更纰谬的是,课题组发现11,12-EET的促再生后劲依赖于GSDMD在巨噬细胞与肌肉干细胞之间形成灵验的代谢物传递通谈。这一发现发达了一种巨噬细胞和干细胞之间新式的代谢物通信神色,拓展了咱们对细胞膜上孔谈功能的新意识。
多面手——11,12-EET
在组织拔擢经过中,由于毁伤微环境中促进再生因子的浓度常常处于较低水平,机体需要依赖一系列精确调控的计策来放大这些关节信号的传导,以达成快速高效的组织拔擢经过。
通过分析对照和11,12-EET处分的原代肌肉干细胞的转录组数据,课题组进一步发现,11,12-EET马虎匡助毁伤微环境中促拔擢的滋长因子凝华,灵验放大滋长因子传导的下流信号,从而加快组织拔擢和再生进度。
既然11,12-EET有促进干细胞活化的智商,那么这种功能是否具有愈加正常的利用场景呢?
11,12-EET马虎加快组织拔擢和再生进度
课题构成员将11,12-EET的诊疗后劲膨胀到肌肉毁伤、角膜毁伤和皮肤毁伤多种模子中,发现11,12-EET表泄漏正常的促拔擢功能。更令团队成员惊羡的是,它马虎通过扩大肌肉干细胞储备匡助虚弱小鼠复原肌肉活力,并不错促进东谈主肌肉组织华夏代肌肉干细胞的增殖。
团队成员池哲勖说:“这为11,12-EET临床筹商利用的远景提供了有劲的支援chatgpt 文爱,为伤口愈合、创面拔擢和虚弱肌肉退化等病症的诊疗提供了新的想路。”
